Удивительная химия - Страница 5
Теоретические построения древнегреческих философов были первыми научными построениями. На их основе через много веков зародились современные науки, в числе которых была и химия. Без древней атомистической теории не только химия, но и все естественные науки не могли бы развиваться. Однако на протяжении еще многих столетий лишь малая часть философов и ученых разделяла гипотезу о существовании атомов. Ну а все, что касалось размеров атомов, их массы, формы и т. п., оставалось тайной за семью печатями, и не было даже надежды, что эту тайну удастся раскрыть.
Что такое элемент
Лукреций, написавший свою поэму на латинском языке, часто использовал слово principium, которое означает «основа, первоначало». Есть в латинском языке и другое близкое понятие: elementum. Оно означает «вещество, стихия», а во множественном числе (elementa) – «основания, основные начала». В древности было распространено изречение: «Как слова состоят из букв, так и тела – из элементов». Любопытно, что по одной из версий слово elementum происходит от названия следующих по алфавиту латинских согласных: l, m, n («el» – «em» – «en») и окончания t («tum»).
Современное понятие «элемент» появилось в XVII веке. Английский ученый Роберт Бойль (1627–1691) определял элементы не умозрительно, как древние, а чисто практически. Рассуждал он примерно так: «Если вещества невозможно разложить на более простые, значит они являются элементами и состоят из атомов только одного сорта. (Сейчас такие вещества называют простыми.) Если же вещества разлагаются под действием кислот или при сильном нагреве, значит эти вещества состоят из разных элементов и являются сложными веществами».
В те времена считать какое-либо вещество элементом можно было только условно; ведь никто не сомневался в том, что со временем химики сумеют разложить на составные части некоторые из тех веществ, которые признавались простыми. Вот что писал по этому поводу французский химик Антуан Лоран Лавуазье (1743–1794) в своем учебнике «Элементарный курс химии», изданном в 1789 году: «Все вещества, которые мы еще не смогли никаким способом разложить, являются для нас элементами; но не потому, что мы могли бы утверждать, что эти тела, рассматриваемые нами как простые, не состоят из двух или большего числа начал, но… потому, что мы не имеем никаких средств их разделить, эти тела ведут себя, с нашей точки зрения, как простые, и мы не должны считать их сложными до тех пор, пока опыт или наблюдения не докажут нам этого».
Сам Бойль, например, полагал, что металлы не являются простыми веществами и потому возможны превращения одних металлов в другие. Такого же мнения придерживался и выдающийся английский физик Исаак Ньютон (1643–1727), потративший массу времени и здоровья на алхимические опыты.
Со временем химики достигли больших успехов в изучении различных превращений. Но у них еще не было достаточно надежных методов, которые бы позволяли различать простые и сложные вещества. Отсюда возникали ошибки даже у известных ученых. Сам Лавуазье в своем учебнике привел таблицу примерно из 30 простых тел. Среди них были действительно простые вещества (газы – кислород, азот, водород; металлы – серебро, золото, медь, олово, железо, ртуть, никель, марганец и др.; неметаллы – сера, фосфор, углерод, хлор). А были и сложные вещества, о чем тогда еще не было известно (например: известь, глинозем, кремнезем). Воду, например, долго считали элементом, пока Лавуазье не опроверг это мнение и не написал в 1783 году сочинение, которое он назвал «Статья, имеющая целью доказать, что вода не простое вещество, не элемент в собственном смысле слова, но что она может быть разложена и получена вновь». Оказалось, что вода образуется при горении многих веществ, например водорода. А с помощью раскаленного железа воду можно снова разложить на водород и кислород (Лавуазье пропускал для этого пары воды через раскаленный ружейный ствол).
Основу современной атомистики заложил английский ученый Джон Дальтон (1766–1844). Свою теорию он вывел исходя из сделанного им открытия. Оказалось, что многие элементы могут соединяться друг с другом в разных соотношениях, при этом образуются разные вещества. А самое главное – в этих веществах массы элементов кратны друг другу и соотносятся как небольшие числа. Например, углерод может соединяться с кислородом в массовых соотношениях 3:4 или 3:8 (при этом образуется либо угарный газ, либо углекислый); сера соединяется с кислородом в соотношении 1:1 или 2:3, азот с кислородом – в соотношении 7:4, 7:8, 7:12, 7:16 и 7:20 (правда, Дальтону были известны не все эти соединения). Платон, наверное, долго ломал бы голову, соображая, как эти странные соотношения можно подогнать к его теории строения мира. Дальтон же рассудил просто. Существуют атомы углерода, кислорода, серы, азота, причем атомы каждого элемента имеют свою массу. В разных веществах атомы соединяются друг с другом в строго определенных соотношениях. Например, если один атом азота «весит» 7 условных единиц, а один атом кислорода – 8 таких же единиц, то соотношение атомов в разных оксидах азота (так называются соединения азота с кислородом) будет: 2:1, 1:1, 2:3, 1:2 и 2:5.
Рассуждая таким образом и основываясь на экспериментах, Дальтон составил первую таблицу атомных масс. Атомы разных элементов он обозначил разными фигурками, запомнить которые было довольно трудно. Позднее шведский химик Йенс Якоб Берцелиус (1779–1848) предложил очень простой способ для обозначений атомов – по первой букве названий элементов на латинском языке. Если же буквы у разных названий оказывались одинаковыми, тогда он добавлял вторую букву. Например, водород на латыни – Hydrogenium (в переводе – «рождающий воду»), знак элемента Н; углерод – Carboneum, знак С; кислород – Oxygenium («рождающий кислоты»), знак О; азот – Nitrogenium («рождающий селитру»), знак N и т. д. Теперь различные оксиды азота можно было записать совсем просто: N2O, NO, N2O3, NO2 и N2O5. На таком «языке» говорят сегодня все химики мира; написав формулы, китайский химик легко поймет норвежского, хотя норвежец может не знать ни одного слова по-китайски, и наоборот.
Помимо аргументов, основанных на представлениях о кратных соотношениях, в пользу атомистического учения приводились и другие доводы. Например, существование красивых кристаллов разной формы – простой (как у поваренной соли, кристаллы которой образуют кубики) или сложной (рис. 1.5) – можно было объяснить тем, что они построены из атомов, которые соединены друг с другом в пространстве по определенным правилам.
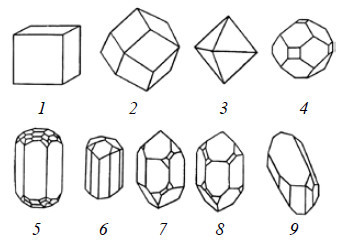
Рис. 1.5. Кристаллы разной формы: 1 – каменная соль; 2 – гранат; 3 – алмаз; 4 – квасцы; 5 – берилл; 6 – турмалин; 7 – «правая» форма кварца; 8 – «левая» форма кварца; 9 – медный купорос
Дальтон, чтобы его теория была понятной и наглядной, демонстрировал на своих лекциях разноцветные кубики, которые символизировали атомы разных элементов. Из этих кубиков, подбирая их в нужном количестве, он составлял различные химические соединения. Не все слушатели хорошо понимали суть его теории. Когда одного из студентов спросили, что такое атомы, он ответил: «Атомы – это разноцветные деревянные кубики, которые мистер Дальтон показывает на лекциях…»
Массы атомов Дальтон выражал в относительных единицах – ведь он не мог взвесить отдельный атом, который так мал, что не виден даже в микроскоп! Можно было бы взвесить кусочек вещества побольше, но тогда для определения массы одного атома надо было точно знать, сколько атомов в этом кусочке. Во времена Дальтона этого не знали. Позднее химики и физики определили, сколько атомов содержится, например, в одном миллиграмме золота – едва заметной маленькой крупинке. Оказалось – астрономическое число: 3·1018 (т. е. 3, умноженное на 10 с восемнадцатью нулями)! Сумели построить и приборы, которые позволили разглядеть отдельные атомы (рис. 1.6). Теперь уже никто не вправе усомниться в том, что атомы существуют на самом деле! Правда, значение греческого слова «атомос» уже не соответствует современным представлениям об атоме как о неделимой частице: атомы состоят из более мелких «деталей» – протонов, нейтронов и электронов, а есть и еще более «элементарные» – кварки. Но этот «конструктор» уже не для химиков – им пользуются физики для «конструирования» казавшихся ранее элементарными частиц – протонов и нейтронов.