Энциклопедия юного аквариумиста - Страница 10
Опасность сероводорода заключается не только в нем самом, но еще и в том, что он участвует в химических процессах, которые уменьшают количество кислорода в воде.
Метан (а болотным газом его называют, потому что много метана на болотах) образуется около дна, в грунте, где разлагаются отмершие части растений, погибшие организмы. Метан вносит свою лепту в отравление аквариума.
Гидрохимический состав воды
Именно потому, что вода хороший растворитель, чистой воды в природе почти нет!
В лабораториях получают дистиллированную – почти чистую воду.
А подземные, речные, водопроводные воды имеют сложный химический состав.
В воде водоемов, где живут самые разнообразные обитатели и растут самые разнообразные растения, идут сложные биологические процессы, меняющие химический состав воды и насыщающие ее органическими веществами. Все это и определяет химический состав воды в аквариуме.
Аквариумисты должны постоянно учитывать некоторые параметры воды, знать, какие химические реакции в ней происходят.
Поэтому они пользуются специальными терминами, которые встречаются в любой литературе по аквариумистике, такими как жесткость воды, водородный показатель pH, редокс-потенциал. Без этих терминов аквариумисту никуда…
Что же это такое?
Постараемся разобраться! (А лучше всего привлечь родителей – пусть помучаются! :-))
Активная реакция воды (водородный показатель pH)
Химическая формула воды H2O.
Это значит, что молекула воды состоит из двух атомов водорода и одного атома кислорода.
Но под влиянием слабого природного электричества часть молекул воды распадается на ионы. Этот процесс называется диссоциацией.
Соли, кислоты и щелочи, которые растворены в воде, тоже распадаются на ионы.
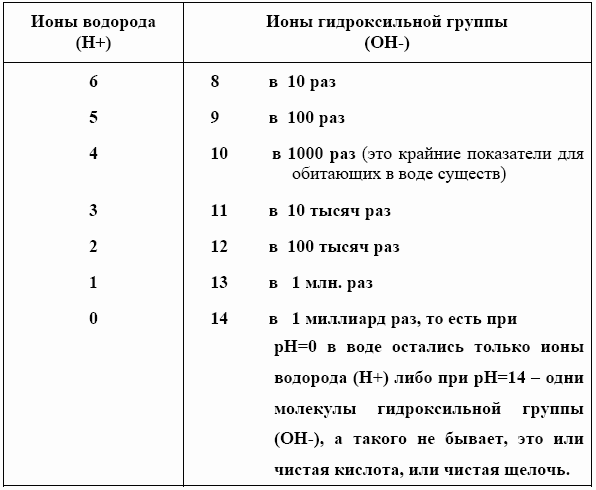
Ионы воды обозначают так: H+ (свободные водородные ионы) и OH– (гидроксильная группа). Плюс на минус дает сами знаете что. То есть если тех и других в воде поровну, то говорят, что вода имеет нейтральную реакцию.
В нейтральной воде распадается (диссоциирует) примерно одна молекула на каждые 10 000000.
То есть в ней ионов водорода 10 в минус 7 степени: 10 -7. (И ионов гидроксильной группы OH– тоже 10 -7.).
Активная реакция такой воды обозначается водородным показателем с цифрой 7. Почему 7, а не 6 или не 10? Посчитайте нули в десяти миллионах! Записывают водородный показатель латинскими буквами pH. И говорят, что у нейтральной воды pH7.
Если же в воде оказывается больше ионов водорода (Н+), вода становится кислой, если ионов гидроксильной группы (ОН-), то щелочной.
В качестве показателя активной реакции воды будет десятичный логарифм показателя ионов с обратным знаком. (А логарифм, если кто забыл, это вот что: x=10y, ® y=lgx, обратный же знак, потому, что у ионов водорода, растворенных в воде степень минусовая, их же там очень мало). (Вы что-нибудь поняли? Один из авторов этой книги понимает и уверен, что все ясно, яснее некуда, другой ни черта не понял! :-))
Это была теория. Можно ее забыть, если кроме головной боли она ничего не вызывает.
Что нужно помнить:
Чтобы узнать, сколько этого самого pH, то есть водородного показателя в воде, придумали шкалу с делениями от 0 до 14.
Нейтральный показатель pH (наиболее предпочтительный) – это деление под номером 7, ровно посередине шкалы. Пишется это, как мы уже знаем, pH7.
Влево от него идут кислые воды (слабокислая – кислая – сильнокислая), вправо – щелочные (слабощелочная – щелочная – сильнощелочная).
Вот как меняется отношение ионов водорода к ионам гидроксильной группы, если посмотреть на показатели pH:
Жизнь в воде возможна в пределах pH 4 – 10. Показатель pH у морской воды равен 8,1–8,3. А вот у пресной воды разброс по шкале сильнее.
Учитывая, что рыбки могут жить в пределах pH от 5 до 9, воду можно разделить так:
pH <5 – сильно кислая,
pH 5–6 – кислая,
pH 6–6,8 слабо кислая,
pH 6,8–7,2 – нейтральная,
pH 7,2–8,0 слабо щелочная,
pH 8,0–9,0 – щелочная,
pH>9 – сильно щелочная.
Показатель pH вообще очень нестабилен: он зависит от температуры воды, от жизнедеятельности растений (значит и от освещения), от того, подвижна ли вода в водоеме или нет.
Разные слои воды могут иметь разный показатель pH. Днем, когда водные растения вырабатывают кислород в процессе фотосинтеза, они подщелачивают воду и pH поднимает вправо по шкале. Но достаточно подуть ветерку над озером, или заработать фильтру в аквариуме, как pH разных слоев уравнивается.
Это еще одна причина, по которой стоячая вода для аквариума – смерть! Потому что без вертикального вращения воды в аквариуме, растения могут так повысить pH в верхних слоях, что у них начнется разрушение листьев и стеблей.
В большинстве случаев показатель pH аквариумной воды колеблется в рамках 6,5–8,5. Но если аквариум сильно загрязнен, давно нечищен и грунт его закис, то водородный показатель у дна может составить и pH 5,5.
Если в аквариуме есть растения, то днем pH, как мы уже говорили, перемещается в щелочную сторону, а ночью, когда они не вырабатывают, а потребляют кислород – в кислую сторону.
Но при всей этой подвижности водородного показателя pH, у обитателей аквариума есть свои рамки. Они называются pH – барьеры. И выход за них в любую сторону по шкале водородного показателя (в кислую или в щелочную) – гибелен.
Так, если перенести аквариумных жителей из одной воды в другую, которые отличаются своим pH больше чем на 0,8–1,0 – то рыбки могут получить сильнейший шок, а у растений начнут отмирать листья и стебли.
Все это происходит потому, что в природе и рыбки, и растения живут в разных условиях. Кто-то в быстрой речке, кто-то в спокойном озере. А раз условия разные, то и pH – барьеры тоже разные.
Если в аквариуме посажены растения с разными pH-барьерами, это может привести к явлению, которое принято называть несовместимостью.
Например, широко распространены в аквариумах три таких растения, как кабомба, валлиснерия и элодея. У кабомбы граница pH-барьера в щелочную сторону заканчивается на 8. В более щелочной воде она прекращает вырабатывать кислород и потреблять углекислый газ (а значит, и расти). У валлиснерии эта граница на pH 10, а у элодеи на pH 11.
Если эти три растения будут вместе, элодея будет подщелачивать верхние слои воды без всякого для себя вреда, а кабомба и валлиснерия не смогут выдержать рядом с ней и будут потихоньку отмирать, потому что при таких показателях pH расти не смогут.
Рыбки тоже сильно реагируют на изменение показателя pH. От его снижения у них может повыситься аппетит, но это такое же обманчивое явление, как и при избытке углекислого газа. На самом деле рыбки не могут усвоить питательные вещества и голодают.
Некоторые рыбки (барбусы и др.) начинают чесаться о грунт и камни, а сомики, несмотря на отменный аппетит, умирают от истощения. Кровь начинает хуже захватывать кислород, и, несмотря на усиленное дыхание, рыбки задыхаются.
Но иногда, чтобы спровоцировать нерест у рыб, нужно изменить им показатель pH на короткий срок. Поэтому при описании рыбок очень часто указывают два необходимых им показателя рН: один нужен для жизни, другой для нереста.
Наиболее подходящая вода для большинства обитателей аквариума должна иметь колебания pH около 7.
Этого достигают, в основном, правильно ухаживая за аквариумом: поддерживают постоянное принудительное ее перемешивание с помощью аэрации и фильтрации, регулярно (обычно еженедельно) меняют часть воды, следят за чистотой в водоеме.