Большое космическое путешествие - Страница 21
Допустим, две звезды на небе обладают одинаковой яркостью, но я знаю, что светимость у одной из них в 10 000 раз выше, чем у другой. Что можно сказать об этих звездах? Звезда с большей светимостью должна находиться дальше. Во сколько раз? В 100 раз. Как у меня получилось 100? Да, 100 в квадрате равно 10 000.
Вы только что изучили некоторые из глубочайших проблем астрофизики конца XIX – начала XX века. Так, Больцман и Планк стали героями науки, поскольку осознали материал, изложенный в двух предыдущих главах.
Глава 6
Звездные спектры
Автор: Нил Деграсс Тайсон
Что на самом деле происходит внутри звезды? Звезда – это не просто маячок, который достаточно включить, чтобы с его поверхности полился свет. Глубоко в недрах звезды протекают термоядерные процессы, в результате которых выделяется энергия, и эта энергия постепенно пробивается к поверхности звезды, где высвобождается и со скоростью света летит на Землю, а также во всю Вселенную. Давайте проанализируем, что происходит при продвижении такой тучи фотонов сквозь материю – ведь без сопротивления при этом не обходится.
Для начала нужно понять, через что пробиваются фотоны на пути к поверхности Солнца. Наша звезда и большинство остальных состоят преимущественно из водорода – самого распространенного элемента во Вселенной. 90 % всех атомных ядер – это ядра водорода, 8 % – ядра гелия, а оставшиеся 2 % приходятся на все остальные элементы Периодической системы. История всего водорода и большей части гелия прослеживается вплоть до Большого взрыва, тогда же появилось ничтожное количество лития. Остальные элементы уже позже синтезировались в звездах. Если вы – поклонник той точки зрения, что земная жизнь есть нечто уникальное, то должны считаться со следующим важным фактом: если расставить по частоте встречаемости пять важнейших элементов во Вселенной – водород, гелий, кислород, углерод и азот, то этот набор будет очень напоминать химический состав человеческого организма. Какова основная молекула в теле человека? Это вода – вы на 80 % состоите из H2O. Если расщепить воду, то выделится водород, элемент номер один в человеческом организме. В вас совершенно нет гелия – за исключением того, что вы вдыхаете из наполненного гелием шарика, чтобы изменить голос на писклявый. Но гелий химически инертен. Он расположен в крайнем правом столбце Периодической таблицы; это значит, что его внешняя электронная оболочка целиком заполнена, там нет свободных «парковочных мест», куда можно было бы вставить электроны от других атомов, поэтому гелий ни с чем не реагирует. Даже если бы у вас был гелий, вам было бы не на что его применить.
Далее в человеческом организме идет кислород – опять же, его много, так как он присутствует в молекуле воды H2O. После кислорода идет углерод – основа всей органической химии. Далее идет азот. Если не считать гелия, который ни с чем не реагирует, то в земном человеческом организме наиболее распространены те же элементы, что и в космосе. Если бы мы состояли из какого-то редкого элемента, например из изотопа висмута, то могли бы утверждать, что на этой планете произошло что-то уникальное. Но учитывая, что мы состоим как раз из тех элементов, что наиболее распространены в космосе, приходится смиренно признать, что с химической точки зрения мы ничем не примечательны. С другой стороны, есть нечто поучительное и даже вдохновляющее в осознании, что все мы действительно сотворены из звездного вещества. Как будет рассказано в нескольких следующих главах, кислород, углерод и азот синтезируются в звездах спустя миллиарды лет после Большого взрыва. Мы родились во Вселенной, живем в этой Вселенной, и Вселенная живет внутри нас.
Рассмотрим газовое облако – космическую смесь водорода, гелия и остальных элементов – и обратим внимание на то, что там происходит. В центре атома находится ядро, состоящее из протонов и нейтронов, вокруг ядра вращаются по орбитам электроны. Удобно, пусть и графически неверно, представлять себе простую классическую квантовую модель атома, которую Нильс Бор предложил около 100 лет назад. У такого атома есть основное состояние – такая орбита, на которой электрон обладает наименьшей внутренней энергией; назовем это основное состояние «энергетический уровень 1». На следующей возможной орбите электрон будет уже в возбужденном состоянии, это будет энергетический уровень 2. Давайте изобразим атом с двумя энергетическими уровнями, чтобы не усложнять картину (рис. 6.1). В атоме есть ядро и облако электронов, находящихся «на орбитах» вокруг ядра. Но эти орбиты не похожи на планетные, о которых мы говорили, обсуждая гравитацию, планеты и Ньютона. Вообще, здесь было бы правильнее говорить не об орбитах, а об орбиталях. Они называются орбиталями, поскольку похожи на орбиты, но могут принимать самые разные формы. На самом деле, это «вероятностные облака», в разных частях которых с той или иной вероятностью может находиться электрон. Электронные облака. Некоторые из них сферические, другие – продолговатые. Орбитали объединяются в семейства, для одних семейств характерны более высокие энергии, чем для других. Давайте абстрагируемся от этого и поговорим просто об энергетических уровнях, но на самом деле будем рисовать орбитали, занятые электронами, вращающимися вокруг атомных ядер.
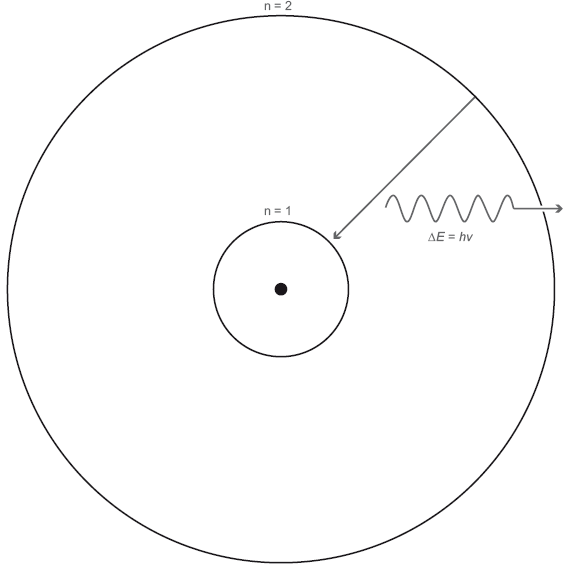
Рис. 6.1. Энергетические уровни в атоме. Показан простой атом с двумя электронными орбиталями, n = 1 и n = 2. Если электрон переходит со второго энергетического уровня на более низкий первый энергетический уровень, он излучает фотон с энергией ΔE = hν, где ΔE = E2 – E1 – это разница в энергии между первым и вторым энергетическим уровнем. После того как электрон окажется на первом энергетическом уровне, он может поглотить фотон с энергией ΔE = hν и вновь подняться на энергетический уровень 2.
Предоставлено Майклом Строссом
Ядро – это точка в центре атома. Энергетический уровень n = 1 соответствует сферической орбитали, расположенной ближе всего к ядру. Энергетический уровень n = 2 – это сферическая орбиталь, расположенная чуть дальше от ядра. Электрон на энергетическом уровне n = 2 уже не так плотно связан с ядром. Электроны и протоны притягиваются; нужна энергия, чтобы отодвинуть электрон от ядра на более отдаленную орбиталь. Энергетический уровень 2 обладает более высокой энергией, чем энергетический уровень 1.
Допустим, есть электрон в основном состоянии, на энергетическом уровне 1. Он не может зависнуть где-нибудь между первым и вторым энергетическими уровнями. Там просто нет места. Это же квантовый мир. Плавных изменений там не бывает. Чтобы электрон мог перескочить на следующий уровень, ему необходимо сообщить энергию. Он должен каким-то образом поглотить энергию, и в данном случае отличным источником энергии был бы фотон. Фотон попадает в электрон, но электрону подойдет не любой фотон, а только такой, энергия которого равна энергетической разнице между двумя уровнями. Заметив такой фотон, электрон проглатывает его и перескакивает на энергетический уровень 2. Если в фотоне чуть больше или чуть меньше энергии, электрон его просто пропустит. Еще отмечу, что атомам, в отличие от людей, не нравится пребывать в возбужденном состоянии. Спустя достаточное время электрон с энергетического уровня 2 спонтанно спустится на более низкий энергетический уровень 1 (как показано прямой стрелкой на рис. 6.1).
Бывает, что достаточное время – это миллионная доля секунды. Электрон недолго пребывает в возбужденном состоянии, будучи в атоме. Итак, что должно произойти, когда электрон опускается на более низкий энергетический уровень? Он должен испустить фотон – новый, но с той же энергией, которую принял с предыдущим фотоном. При переходе на более высокий энергетический уровень фотон поглощается. При переходе на более низкий энергетический уровень фотон излучается, как показано волнистой стрелкой на рис. 6.1. Согласно знаменитому уравнению Эйнштейна, энергия E этого фотона равна hν, где h – постоянная Планка, а ν – частота фотона. Энергия излученного фотона в точности равна разнице между двумя энергетическими уровнями ΔE.(Заглавная греческая буква «дельта», Δ, часто используется для обозначения разницы или изменения величины). В результате получаем тождество ΔE = hν, позволяющее вычислить частоту того фотона, который был излучен электроном, когда тот опустился со второго на первый энергетический уровень.